EVALUACIÓN DE DOS DILUYENTES COMERCIALES PARA LA CONGELACIÓN DE SEMEN BOVINO EN CONDICIONES DE CAMPO
EVALUATION OF TWO COMMERCIAL EXTENDERS FOR FREEZING BOVINE SEMEN UNDER FIELD CONDITIONS
*Reinaldo De Armas. Universidad de Panamá, Facultad de Ciencias Agropecuarias, Panamá.
reinaldode.armas@up.ac.pa https://orcid.org/0000-0003-2488-0113
Andrick Camaño. Universidad de Panamá, Facultad de Ciencias Agropecuarias, Panamá.
gabriel.camaño@up.ac.pa https://orcid.org/0009-0003-6027-998X
Neftalí Aparicio. Universidad de Panamá, Facultad de Ciencias Agropecuarias, Panamá.
neftali.aparicio@up.ac.pa https: //orcid.org/0000-0002-8402-6923
Reynaldo Vargas. Universidad de Panamá, Facultad de Ciencias Agropecuarias, Panamá.
reynaldo.vargas@up.ac.pa https://orcid.org/0000-0002-5420-9761
*Autor de Correspondencia: reinaldode.armas@up.ac.pa
Recibido: 20/02/2025 Aceptado: 14/04/2025
DOI https://doi.org/10.48204/j.ia.v7n2.a7473
![]()
Resumen. Se evaluó el efecto de dos diluyentes comerciales (Optidux - liposomas y Triladyl - yema de huevo), sobre variables de calidad y funcionalidad espermática después de la descongelación. Se realizaron tres colectas de un toro cruzado (F1 Simmenthal x Gyr) mediante electro eyaculación a cuatro días de intervalo. La dilución empleada fue de 1:3. La equilibración se desarrolló en un contenedor de FOAM con hielo por tres horas a 4 °C. Se congelaron 10 pajillas de 0.5 ml por diluyente en cada colecta (consideradas como réplicas). La congelación se inició en vapores de nitrógeno líquido por 15 min antes de introducirlas en el mismo. Al semen post descongelación (30 s a 35 °C) se le realizó evaluaciones de motilidad total y progresiva, vigor, viabilidad y patologías morfologías, las mismas fueron observadas a las cero y dos horas de incubación. El análisis estadístico se realizó mediante la prueba de Chi-Cuadrado, y solo se encontró diferencias estadísticas (p<0.02) para viabilidad espermática a favor del diluyente Triladyl, con una efectividad de 32% a las cero horas de la descongelación; en tanto a las dos horas de incubación su efectividad fue menor, pero se mantuvo el Triladyl como el mejor (p<0.007). Se concluye que tanto el diluyente Optidux como el Triladyl brindaron similares resultados in vitro para calidad seminal post descongelación, lo que nos sugirió que tanto los liposomas como la yema de huevo evitaron daños estructurales durante la congelación - descongelación que permitieron preservar eficientemente la motilidad seminal.
Palabras clave: Electroeyaculación, liposomas, motilidad, vigor.
Abstract. The effect of two commercial semen extenders—Optidux (liposome-based) and Triladyl (egg yolk-based)—on post-thaw sperm quality and functionality parameters was evaluated. Semen was collected from a crossbred bull (F1 Simmental × Gyr) using electroejaculation, with three collections performed at four-day intervals. The dilution ratio used was 1:3. Equilibration was conducted in a FOAM container with ice for three hours at 4 °C. For each collection, ten 0.5 ml straws per extender were frozen, and each set was considered a replicate. Cryopreservation was initiated by exposing the straws to liquid nitrogen vapor for 15 minutes before immersion in liquid nitrogen. Post-thaw semen (thawed for 30 seconds at 35 °C) was evaluated for total and progressive motility, vigor, viability, and morphological abnormalities. These parameters were assessed at 0 and 2 hours of incubation. Statistical analysis was performed using the Chi-square test. Significant differences (p<0.02) were observed in sperm viability, with Triladyl® showing superior performance (32% viability at 0 hours post-thaw). Although viability decreased at 2 hours, Triladyl remained the most effective extender (p<0.007). In conclusion, both Optidux and Triladyl provided comparable in vitro results for post-thaw semen quality, suggesting that both liposome- and egg yolk-based extenders effectively mitigated structural damage during the freezing–thawing process, thereby preserving sperm motility.
Keywords: Electroejaculation, liposomes, motility, vigor.
INTRODUCCIÓN
La criopreservación de espermatozoides es una biotecnología reproductiva fundamental que promueve la preservación indefinida y su unión con la inseminación artificial ha permitido la difusión de material genético de óptima calidad y potenciar los programas de mejoramiento genético, así como la preservación de especies en peligro de extinción. De manera similar, ha ayudado a reducir los costos de producción al eliminar el uso de reproductores en monta natural y también el contagio de enfermedades de transmisión sexual (Castelo et al., 2008).
Según Viñán et al. (2019), la criopreservación causa diferentes tipos de estrés sobre la célula espermática, principalmente por el enfriamiento, así como por el estrés osmótico y oxidativo o mecánicamente por la formación de cristales de hielo elementos que afectan la fertilidad por daños en la estructura de la membrana, funciones de los organelos y el potencial de la membrana. Consecuentemente, Brass (2001) señaló que estas alteraciones en los espermatozoides están representadas por la pérdida de la motilidad con un incremento de movimientos retrógrados y circulares, se genera en la descongelación lesiones del acrosoma y de la membrana plasmática con una reducción del metabolismo.
Con el propósito de reducir el daño de los espermatozoides producto de la criopreservación en un principio se adicionaba yema de huevo o leche a los diluyentes como crioprotector (Crespilho et al., 2012). En concreto, la posibilidad de sustituir la yema de huevo fresco o la leche resulta muy deseable, dada que la composición heterogénea entre las diferentes fuentes en el tiempo, junto con el potencial riesgo de contaminación por agentes patógenos que representan un peligro inminente de transmisión y diseminación de enfermedades emergentes. Para tratar de minimizar estos efectos dañinos del descenso de temperatura sobre la membrana celular, existen diferentes alternativas como el uso de yema de huevo en polvo pasteurizada o albumina del suero bovino (BSA), de acuerdo con lo publicado por Martínez et al., (2022), o el empleo lecitinas de origen vegetal como la lecitina de soja o el uso de liposomas según Vidal et al., (2013).
La alternativa más reciente como aditivo para los medios de congelación son los diluyentes basados en liposomas, estos poseen una excelente concentración y composición de fosfolípidos que garantizan la protección celular frente a las lesiones criogénicas producidas durante la congelación de semen (Bergeron y Manjunath, 2006). El Optidux es un diluyente de alta calidad para semen fresco o congelación, basado en liposomas sintetizados (sin proteína animal), utilizado para remplazar el uso de la yema de huevo, permitiendo una preparación y preservación segura y de alta calidad en la dilución de semen fresco o para ser congelado (IMV-Technologies, 2014).
Con esta opción (Optidux), se evita el transporte de microorganismos patógenos, producción de metabolitos y toxinas nocivas de una explotación a otra. Permite un equilibrio seguro de 24 horas, por lo cual brinda la posibilidad de una mejor organización del trabajo, haciéndolo más flexible. Estudios reportaron que la utilización de diluyentes a base de soya en lugar de yema de huevo, para evitar la reducción de la motilidad y obtener mejores resultados postdescongelación (Roof et al., 2012). Funciona significativamente mejor que la yema de huevo con un bajo número de espermatozoides por dosis. Los parámetros de motilidad son significativamente más altos, que en los diluyentes de yema de huevo Tris o lecitina de soya. Por otra parte, al reducir las posibilidades de contaminación por fuentes de origen animal y simplificar la preparación del diluyente y disminuir el tiempo del procedimiento es “per se” una ventaja, ya que este se agrega directamente al semen lo que permite que se puedan realizar los procesos de acondicionamiento del eyaculado en la propia finca, para inseminación en fresco o para su congelación sin disminuir la vitalidad espermática (IMV-Technologies, 2014).
Diferentes medios se han formulado a partir de lecitina de soya y que podrían constituir alternativas potenciales para la criopreservación del semen (Akhter et al., 2012). Por lo anteriormente planteado, han sido empleados sustitutos de la yema de huevo definidos químicamente y que no provienen de fuentes animales, como los ensayados por Gamal, El-Maaty y Rawash (2016) y El-Sisy et al., (2018).
Por tanto, el objetivo de esta investigación fue comparar el efecto de dos diluyentes comerciales (basados en yema de huevo Triladyl® o liposomas Optidux®) sobre algunas variables de calidad y funcionalidad de los espermatozoides después de la descongelación evaluadas in vitro.
MATERIALES Y MÉTODOS
En el experimento se empleó el semen de un toro del cruzamiento F1 (Simmenthal x Gyr) de tres años, obtenido por electro eyaculación y se realizaron tres extracciones a intervalos de cuatro días. La dilución empleada fue de 1:3 (semen-diluyente) para ambos diluyentes (Triladyl-Yema de Huevo y Optidux-Liposomas Sintéticos). La equilibración se desarrolló en un contenedor de espuma de poliestireno con hielo, por tres horas manteniéndose una temperatura de 4 °C. Se congelaron 10 pajillas de 0.5 ml por diluyente en cada colecta (consideradas como réplicas).
La congelación se inició en vapores de nitrógeno líquido por 15 minutos antes de introducirlas finalmente en el mismo. Al semen post descongelado (30 s a 35 °C), se le realizó evaluaciones de motilidad total y progresiva, vigor, viabilidad y patologías morfologías, las mismas fueron observadas a las cero y dos horas de incubación (37 °C). Se evaluó el efecto de dos diluyentes comerciales, Triladyl y Optidux, sobre la calidad del semen post descongelación.
El diseño experimental incluyó tres repeticiones por tratamiento (diluyente y tiempo), y los datos se analizaron con la prueba de Chi-cuadrado, considerando diferencias estadísticamente significativas valores de p<0.05. Los resultados fueron representados mediante gráficos de barras con proporciones e intervalos de confianza para identificar diferencias significativas entre diluyentes.
RESULTADOS Y DISCUSIÓN
Los resultados de viabilidad espermática post descongelación obtenidos por los diluyentes A (Triladyl-Yema de huevo) y B (Optidux-Liposomas sintéticos), se muestran en la figura 1 y evidenciaron diferencias estadísticas significativas (p<0.02) entre las medias de los dos diluyentes a las cero horas post descongelado a favor de tratamiento A.
Figura 1
Porcentajes medios de espermatozoides vivos, A y B indican diferencias significativas entre diluyentes a los distintos tiempos de evaluación, siendo p<0.02 a las cero horas y p <0.007 a las dos horas post descongelación.
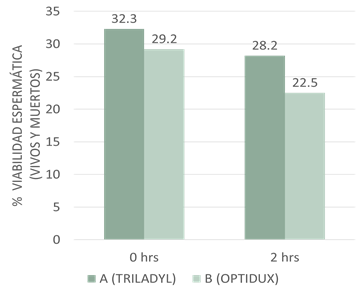
Estos resultados difirieron con los publicados por Ramónez (2013), quien encontró que con el diluyente Triladyl se logró una mejor relación de espermatozoides vivos/muertos 51.8% (p<0.05), en comparación a los diluyentes a base de Trehalosa (33.8%) y sacarosa (31.8%) (p<0.09), en este estudio los resultados alcanzados por el Triladyl fueron superiores, mientras que los otros dos crioprotectores evaluados mostraron resultados similares a los alcanzados en nuestro estudio con el Triladyl. A pesar de que en el ensayo se empleó un mismo semental y que en la literatura revisada no se encontró referencias sobre este cruzamiento, es posible que la diferencia entre los resultados de este autor y los nuestros pudieron deberse a un efecto racial o individual del toro empleado.
En apoyo a lo antes planteado, Moncayo (2016), encontró diferencias entre los porcentajes de espermatozoides vivos en diferentes razas bovinas (Holstein, Pizán y Pardo Suizo), dando como resultado que el semen de la raza Pizán congelado con Triladyl presentó un mayor número de espermatozoides vivos (82%), con respecto a las otras razas evaluadas. Esta raza es considerada como criolla, proveniente de los andes ecuatorianos y de origen Bos taurus, por lo que su alto grado de adaptación pudiera influir en su gran capacidad de resistencia seminal a las bajas temperaturas; mientras que Córdova et al., (2020) publicó porcentajes de 74.5, 74.5 y 72.5% para las razas Charolais, Brahman y Simbrah respectivamente, no encontrando diferencias estadísticas a la descongelación del semen.
En los resultados obtenidos para los espermatozoides vivos y muertos después de ser sometidos a incubación por dos horas post descongelación (A:28.2% y B:22.5%), mostraron una diferencia altamente significativa (p<0.007), entre los diluyentes evaluados. Nuestros resultados difieren a los publicados por Medina, Pérez y Cruz (2008), quienes encontraron que la viabilidad espermática presentó un descenso durante el periodo de incubación, siendo a la hora cero de 70.6±1.9 % y de 57.8±3.2 % para la hora cuatro. No obstante, solo se observaron diferencias significativas (p<0.05) entre la viabilidad determinada en las cuatro horas de incubación (57.8±3.2 %) con respecto a las dos primeras horas (68.69±2.4%).
Los resultados de motilidad obtenidos al comparar lo obtenidos por los diluyentes A (Triladyl-Yema de huevo) y B (Optidux-Liposomas sintéticos) evaluados post descongelación se muestran en la figura 2 y no evidenciaron diferencias estadísticas significativas (p<0.05) para las fuentes evaluadas.
Porcentajes medios de motilidad total, A y B indican que no existen diferencias estadísticas significativas entre los diluyentes a los distintos tiempos de evaluación.
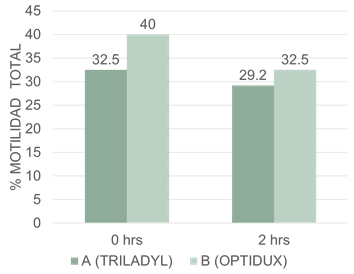
En los resultados obtenidos para motilidad total post descongelación se determinó que no existieron diferencias estadísticas significativas (p<0.05) entre los tratamientos A y B. A pesar de esto se apreciaron valores a las cero horas post descongelación para A:32.5 y B:40.0%. Sin embargo, a las dos horas post descongelación, los valores disminuyeron para A: 29.2 y B:32.5%.
Dichos resultados concuerdan con Carballo et al., (2005), quienes encontraron en su investigación que el semen diluido con Triladyl mostró una motilidad post descongelación un 30.8%, comparado con el diluido con Andromed que aportó solo un 23.8% de motilidad post descongelación.
Sin embargo, hubo diferencias con los resultados de Jiménez et al., (2020), quienes que obtuvieron una motilidad total mayor después de la descongelación en los espermatozoides criopreservados con Triladyl (60.1 ± 2.3%) y Andromed (58.6 ± 2.4%) en comparación con los otros extensores.
Nuestros resultados en cuanto a la motilidad post descongelación con Liposomas concuerdan con los resultados publicados por Murphy et al., (2018), quienes lograron una motilidad total de 41.93 y 59% cuando emplearon diluyentes Andromed y Optixcell. Sin embargo, nuestros resultados difieren con los de Lima et al. (2018), quienes no encontraron diferencias significativas, pero hallaron una motilidad total de 57.8% para el diluyente Andromed y 58.9% para Optixcell. Por otro lado, estos resultados difieren también con los de Janett et al., (2005), ya que el Andromed, presentó en semen bovino, mejores valores para motilidad total con 66. %, comparado con el Bioxcell con 60.9%, mientras que el Triladyl brindó los resultados más bajos con 52.4%. A pesar de que existen múltiples factores que pueden influir en los resultados de la congelación, el diluyente utilizado es una pieza clave.
Las diferencias encontradas entre los hallazgos de las investigaciones antes mencionadas podrían deberse al método de criopreservación, la concentración espermática por pajuelas, factores genéticos y de raza, método de descongelación y prácticas de manejo de los toros que podrían afectar la calidad de los espermatozoides (Morell et al., 2017). En este mismo aspecto Vélez, Rugeles y Vergara (2014) encontró diferencias significativas en cuanto a las diferentes razas evaluadas, siendo valores para Brahman rojo (70,83±21,35), Brahman Blanco (68,53±0,45), Simmental (64,06±25,64), Simmental x cebú (75,21±17,66) y Romosinuano (73,08±23,14), lo que indicó que el encaste racial juega un papel importante en cuanto a esta variable.
De acuerdos con los resultados publicados de Medina et al., (2008) que mostraron un mayor porcentaje de espermatozoides con motilidad total en la hora cero de incubación (49.7±4.7%), porcentaje que disminuyó significativamente a la hora uno y dos (19.1±2.1 y 23.3±1.9%, respectivamente). Aunque a la hora cuatro de incubación el semen mostró porcentajes mucho más bajos (36.8±3.0%), éstos no evidenciaron diferencias estadísticamente significativas (p>0.05).
Sobre este aspecto, nuestros resultados concuerdan con lo publicado por Barth (2018), quien señaló que el semen a utilizar debe tener, según las recomendaciones de la NAAB (National Asociation of Animal Breeders, USA), puede perder de 25% de células motiles a un vigor tres (0=sin movimiento, 5=movimiento rápido donde es difícil seguir una célula) inmediatamente después del descongelado y un 15 % de células motiles a un vigor dos luego de dos horas de incubación a 37 °C, ya que nuestros valores medios de motilidad total se encuentran en un rango adecuado según lo señalado por este autor.
Motilidad individual progresiva
Para la variable de motilidad individual progresiva de las muestras obtenidas post descongelación no se mostraron diferencias (p<0.05, figura 3), sin embargo, se obtuvo valores medios inferiores para el tratamiento A (27.5%) respecto al B (35%), evaluados a las cero horas post descongelación. Mientras que, los valores medios evaluados a las dos horas post descongelación fueron de 25.8% para el tratamiento A y 27.5% para el tratamiento B.
Porcentajes medios de motilidad progresiva, A y B indican que no existen diferencias estadísticas significativas entre los diluyentes a los distintos tiempos de evaluación.
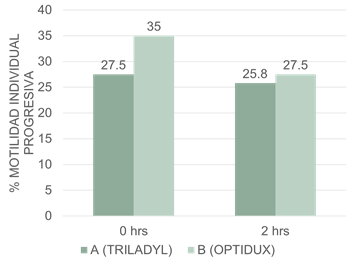
Los valores mínimos aceptables según las normas ISO 9002 para semen bovino post descongelado a las cero y dos horas, indican que se puede perder un 25 y 15 % de células móviles, por lo cual los resultados obtenidos en nuestra investigación se encuentran por encima de dichos valores. De acuerdo con datos publicados por Carballo et al., (2009) y Filipiak et al., (2020), quienes encontraron mayor porcentaje de motilidad con semen criopreservado con diluyente que tenía lipoproteínas de origen animal (30.8%) en contraste al utilizado que poseía lecitina de soya (23.8%), hay similitudes con los valores obtenidos en nuestro estudio; sin embargo, los mismos difieren con Caldevilla, Ferrante y Neild (2020).
En este mismo aspecto, Cabrera y Pantoja (2012), obtuvieron en sus resultados valores de motilidad progresiva post descongelación de cuatro toros se encontraban entre 60 a 70%, mientras que Quispe (2018) publicó valores a las cero y dos horas post descongelación, de 75.5 y 45.3% respectivamente. La diferencia existente en cuanto a estos autores puede deberse a que en el primer caso solo realizó evaluación a las cero horas post descongelado y por ello el porcentaje fue mayor, también se pudiera considerar el protocolo de descongelación empleado y la evaluación subjetiva, ya que esta puede variar los resultados en dependencia de la experiencia individual del investigador que realizó la misma.
Por otro lado, cabe mencionar que nuestros resultados de motilidad individual progresiva con el uso del diluyente a base de liposomas concuerdan con Murphy et al., (2018), quienes evaluaron cinco toros de la raza Holstein Friesian, donde encontraron diferencias significativas para la motilidad progresiva de 31.7 y 45.7%, para Andromed y Optixcell. Sin embargo, difieren con los datos publicados por Bernilla (2024), quien en su investigación señaló para la variable de motilidad individual, los diluyentes y los toros evaluados no evidenciaron diferencias estadísticas significativas, sin embargo, observó que la motilidad fue mayor cuando se empleó Optixcell (62.0%), con respecto al Triladyl (61.7%) y Andromed (51.3%). Sin embargo, Janett et al., (2005), señalaron que el Andromed presento valores de 33.1%, en comparación con Bioxcell y Triladyl, de 31.0 y 23.5% respectivamente, similar a lo publicado por Calle (2020).
De acuerdo con los datos publicados por Medina et al., (2008), no se observaron diferencias significativas (p>0.05) entre las horas de incubación; sin embargo, a las horas se encontraron los valores más altos (26.5±3.0%) y a las cuatro horas los más bajos (18.2±1.6%), lo que indicó que nuestros valores son similares a los presentados por estos autores.
Los valores obtenidos para el vigor entre los dos tratamientos no mostraron diferencias estadísticas significativas (p<0.05, figura 4). Nuestros resultados, tienen coincidencias con los publicados por Ribeiro et al., (2014), quienes encontraron en una evaluación de la criopreservación de espermatozoides extraídos de la cola del epidídimo al utilizar dos métodos de congelación, para el método convencional 2.1±0.8; en una escala de 0 a 5.
Porcentajes medios de vigor a las 0 y 2 horas no presentan diferencias estadísticas significativas entre los diluyentes A y B en los distintos tiempos de evaluación.
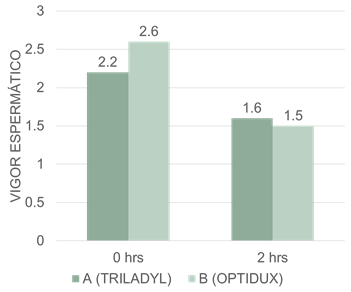
En estudios publicados por Moncayo (2016), se encontró un vigor de tres en el semen de un toro de la raza Holstein evaluado post descongelación con Triladyl, respecto a las razas Pardo Suizo y Pizan, donde alcanzaron solamente valores de dos para ambas razas. Sin embargo, este mismo autor encontró un vigor de dos post descongelación para el toro de la raza Pardo Suizo con la utilización de Andromed, con respecto a la raza Holstein y Pizán, que solo lograron valor de uno.
Por otro lado, Catena y Cabodevila (1999), plantearon que un semen de buena calidad, recientemente descongelado, debe tener normalmente un vigor de 3 a 4, pero al ser evaluado a dos horas post descongelación, estos valores disminuyen hasta valores mínimos de dos, lo cual es semejante a nuestros resultados. Aunque en nuestro estudio hubo un descenso más apreciable del vigor entre las cero horas de descongelado y el observado luego de dos horas de cultivo, del semen congelado en Optidux, no se evidenció diferencias estadísticas; lo que ocurre debido al consumo de sus reservas de energía y acumulación de desechos metabólicos y nos sugiere que esto ocurre independientemente del diluyente empleado.
Patologías Morfológicas
De acuerdo con lo planteado por Rubio-Guillen et al., (2009) en el proceso de crioconservación la membrana plasmática es la primera estructura en ser afectada por los cambios en la composición química o temperatura del medio y se sugiere que la resistencia del espermatozoide a la congelación y toxicidad del medio es influenciada por la composición química de lípidos y proteínas que constituyen la membrana de manera que estos cambios pueden generar colas dobladas, cambios en la pieza intermedia, desprendimiento del acrosoma entre otras alteraciones morfológicos en los espermatozoides congelados. La evaluación de los espermatozoides normales en las muestras obtenidas post descongelación en nuestro estudio no mostraron diferencias estadísticas significativas (p<0.05, figura 5), alcanzaron valores para el tratamiento A:82.3% y B:83. % de espermatozoides normales evaluados a las 0 horas post descongelación. Mientras que para los tratamientos A:80 y B:83% de espermatozoides normales evaluados post descongelación a las dos horas. Por esta razón consideramos que no hubo efecto del diluyente sobre los cambios morfológicos post descongelación.
Porcentajes medios de espermatozoides normales entre el diluyente A y el diluyente B indican que no existe diferencias estadísticas en los tiempos de evaluación.
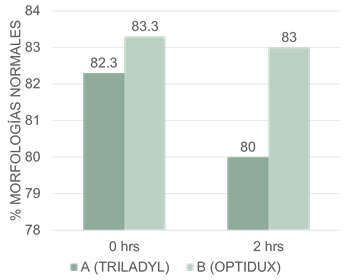
Estos resultados son consistentes con los publicados por Ramónez (2013), quien indicó que no se encontraron diferencias estadísticas significativas en el porcentaje de espermatozoides normales (p<0.05) entre semen sin congelar y semen descongelado.
En este mismo aspecto, Morojon y Morojon (2015), encontraron un valor mínimo de 86% de espermatozoides normales en toros de la raza Brahman, Gyr y razas cruzadas, lo que es una tasa superior a la observada.
En esta misma línea, Vejarano et al., (2005), encontraron una cantidad de espermatozoides normales como promedio fue 86% en toros de diferentes razas, mientras que Montes et al., (2012) en encontraron un 83% de espermatozoides normales, evidenciando un 17% de anormalidades espermáticas. En este mismo aspecto, en estudios publicados por Al Makhzoomi et al., (2008), encontraron valores de 83.7% para espermatozoides normales y menos del 15% en formas anormales.
Nuestros resultados superan los encontrados por Quispe (2018), quien en resultados publicados encontraron un valor promedio de 79.1% de espermatozoides normales, indicando que se encuentra por encima del umbral crítico, lo que sugiere que podría tener una capacidad fertilizante adecuada.
Estos estudios publicados reflejan una variabilidad en los resultados sobre la cantidad de espermatozoides normales, en este mismo aspecto respaldan los evidenciados en nuestra investigación en los tratamientos A y B para esta variable.
Por otro lado, según Evans y Maxwell (1990), el semen de rumiantes debe tener menos de un 15 a 20% de espermatozoides morfológicamente anormales para ser considerado normal y con buena capacidad fertilizante. Ellos advierten que, si la proporción de espermatozoides morfológicamente normales es inferior al 60%, la fertilidad se ve afectada negativamente.
Por otro lado, Medina et al., (2008) demostraron que la morfología espermática no presentó diferencias significativas (p>0.05) en cada una de las horas de incubación analizadas, sin embargo, se encontraron valores de 95.2±0.5 para las cero horas y 93.8±1.1 para las dos horas de incubación en semen de verracos congelados.
CONCLUSIONES
Ambos diluyentes brindan resultados similares tanto a la descongelación como en cultivo in vitro.
Tanto el diluyente a base de liposomas como el que empleó yema de huevo evitaron daños estructurales durante la congelación - descongelación que permitieron preservar eficientemente la motilidad seminal.
RECOMENDACIONES
La utilización del Optidux permite mayor facilidad de uso en campo, puesto que, no requiere ninguna preparación adicional como los diluyentes a base de yema de huevo. A su vez elimina las diferencias en composición entre un huevo y otro.
Al simplificar el trabajo en fincas disminuyendo la manipulación del semen y la preparación de diluyente, eliminar la necesidad de equipos de laboratorio para su preparación disminuye las posibilidades de contaminación en la manipulación.
Este diluyente permite reducir el riesgo de transmisión de enfermedades emergentes, como lo son la gripe aviar o vacas locas, al no contener proteína animal (yema de huevo o leche), disminuye las diferencias en composición de los huevos de un animal a otro y reduce el riesgo de contaminación con agentes patógenos de transmisión por la inseminación o saprófitos que disminuirían la capacidad fecundante de las pajuelas de semen.
Akhter, S., Ansari, M. S., Andrabi, S., Rakha, B., Ullah, N., y Khalid, M. (2012). Soya‐lecithin in extender improves the freezability and fertility of buffalo (Bubalus bubalis) bull spermatozoa. Reproduction in Domestic Animals, 47(5), 815-819.
Al Makhzoomi, A., Lundeheim, N., Håård, M., y Rodríguez-Martínez, H. (2008). Sperm morphology and fertility of progeny-tested AI dairy bulls in Sweden. Theriogenology, 70(4), 682-691.
Barth, A. (2018). The use of bull breeding soundness evaluation to identify subfertile and infertile bulls. Animal, 12(1), 158-164.
Bergeron, A., y Manjunath, P. (2006). New insights towards understanding the mechanisms of sperm protection by egg yolk and milk. Molecular Reproduction and Development, 73(10), 1338–1344.
Bernilla, C. (2024). Evaluación espermática, según tres diluyentes comerciales, en toros de la raza Gyr en la EEA El Porvenir, Tarapoto, Región San Martín. Repositorio Institucional. Universidad Nacional Pedro Ruiz Gallo. Recuperado en línea de: https://repositorio.unprg.edu.pe/handle/20.500.12893/12495
Brass, K. (2001). Inseminación artificial en la especie equina. En: Palma GA. (ed). Biotecnología de la Reproducción. INTA, Buenos Aires, Argentina. 525- 557.
Cabrera, P., y Pantoja, C. (2012). Viabilidad espermática e integridad del acrosoma en semen congelado de toros nacionales. Revista de Investigaciones Veterinarias del Perú, 23(2), 192-200.
Caldevilla, M.; Ferrante, A. y Neild, D. (2020). Utilización de un medio con lecitina de soja para congelar semen equino. InVet, 22(1), 41-49.
Calle, C. (2020). Evaluación de semen bovino utilizando medios comerciales de criopreservación, provincia de Morona Santiago, Ecuador. Trabajo Final Para optar al Grado Académico de Especialista en Reproducción Bovina. Universidad Nacional de Córdoba, Argentina. Recuperado en línea de: https://iracbiogen.com/wp-content/uploads/2021/06/Evaluacion-de-semen-bovino-utilizando-medios-comerciales-de-criopreservacion-provincia-de-morona-santiago-Ecuador-Calle-Crespo.pdf
Carballo, D., Canseco, R., Garcia, R., y Montiel, F. (2005). Comparación de dos diluyentes para criopreservar semen de bovino bajo condiciones de campo húmedo. Tesis Profesional. Facultad de Medicina y Veterinaria, Universidad Veracruzana. Veracruz, México. 42 p.
Carballo, D., Canseco, R., García, R., y Montiel F. (2009). Comparación de dos diluyentes comerciales para criopreservar semen de bovino bajo condiciones de campo en el trópico húmedo. Avances en la Investigación Agrícola, Pecuaria, Forestal y Acuícola en el Trópico Mexicano. Recuperado en línea de: https://www.uv.mx/veracruz/cienciaanimal/files/2013/11/Comparacion-de-dos-diluyentes-comerciales-para-preservar-semen-bovino.pdf
Castelo, T., Frota, T. y Silva, A. (2008). Consideracoes sobre a criopreservacao do semen de caprinos. Acta Veterinaria Brasileira; 2: 67-75. Doi: https://doi.org/10.21708/avb.2008.2.3.885
Catena, M. y Cabodevila, J. (1999). Evaluación de semen bovino congelado. Sitio Argentino de Producción Animal, Recuperado en línea de: http://www.produccion-animal.com.ar/information_tecnica/inseminacion_artificial/05-evaluacion_de_semen_bovino_congelado.pdf
Crespilho, A., Sá Filho, M., Dell’Aqua, J., Nichi, M., Monteiro, G., Avanzi, B., Martins, A., y Papa, F. (2012). Comparison of in vitro and in vivo fertilizing potential of bovine semen frozen in egg yolk or new lecithin-based extenders. Livestock Science, 149(1–2), 1–6. https://doi.org/10.1016/j.livsci.2012.05.011
Córdova, C., Guerra, J., Iglesias, A., Huerta, R., Méndez, M., Gómez, A. y Belloda, J. (2020). Efecto de la raza del toro de carne sobre la calidad espermática de semen descongelado. Agro Productividad, 13(8).
El-Sisy, G., El-Badry, D., El-Sheshtawy, R., y El-Nattat, W. (2018). Effects of Phoenix dactylifera pollen grains extract supplementation on post-thaw quality of Arabian stallion semen. Bulgarian Journal of Veterinary Medicine. 21(1):40-49. ISSN: 1.311-1477. https://doi.org/10.15547/bjvm.1044
Evans G., y Maxwell W. (1990). Salamon’s artificial insemination of sheep and goats. Butterworths. Wisconsin-Madison. U.S.A. 192 p.
Filipiak, Y., Armstrong, E., Aragunde, R., Fila, D., Gil, J., Alvarez, V., Pereira, M., Boggio, J., Larocca, C., Vila, F., Llambi, S. (2020). Calidad y capacidad fertilizante in vitro de semen de toros Criollo Uruguayo criopreservado en dos diluyentes comerciales. Archivos Latinoamericanos de Producción Animal, 28(34).
Gamal, A., El-Maaty, A., y Rawash, Z. (2016). Comparative blood and seminal plasma oxidant/antioxidant status of Arab stallions with different ages and their relation to semen quality. Asian Pacific Journal of Reproduction, 5(5), 428-433.
IMV-Technologies Spain. (2020). OPTIXcell. https://www.imv-technologies.es/producto/optixcell#brochures
Janett, F., Keo, S., Bollwein, H., Hässig, M., y Thun, R. (2005). Comparison of AndroMed®, Bioxcell® and Triladyl® extender for cryopreservation of bull semen. Schweiz Arch Tierheilk, 147, 62.
Jiménez, S., Rivera del Alamo, M., Álvarez-Rodríguez, M., Hidalgo, C., Peña, A., Muiño, R., Rodríguez-Gil, J., y Mogas, T. (2020). In vitro assessment of egg yolk-, soya bean lecithin- and liposome-based extenders for cryopreservation of dairy bull semen. Animal Reproduction Science, 215(106315), 106315. https://doi.org/10.1016/j.anireprosci.2020.106315
Lima, V., Johannisson, A., Ntallaris, T., Al‐Essawe, E., Al‐Kass, Z., Nongbua, T., y Morrell, J. (2018). Effect of freezing bull semen in two non‐egg yolk extenders on post‐thaw sperm quality. Reproduction in Domestic Animals, 53(1), 127-136.
Martínez, J., Duverger, O., Díaz N., Interian, L., Denis, R., López, Z., Quintana, M., y Palacios, A. (2022). Efecto del protector de membrana y la solución descongelante en la calidad in vitro del semen caprino congelado en pastillas. Revista de Salud Animal, 44.
Medina, V., Perez, B., y Cruz, P. (2008). Efecto de la incubación postdescongelación sobre la calidad de espermatozoides crioconservados de cerdo. Orinoquia, 12(2), 149-161.
Moncayo, S. (2016). Evaluación de la calidad seminal de reproductores bovinos antes y después del proceso de criopreservación. Universidad Salesiana. Repositorio Institucional. Recuperado en línea de: https://dspace.ups.edu.ec/handle/123456789/11654
Montes, J., Torres, M., Rugeles, C., Almanza, R., y Guimarães, J. (2012). Inducción in vitro de la reacción acrosómica con heparina en semen congelado de toros brahman y gyr. Revista UDCA Actualidad y Divulgación Científica, 15(2), 431-436.
Morojon, D., y Morojon, L. (2015). Evaluación de la calidad Seminal en toros reproductores en invierno y verano en el departamento del Cesar. Barranquilla: Universidad Nacional de Cordoba.
Morrell J., Nongbua, T., Valeanu, S., Verde, I., Lundstedt-Enkel, K., y Edman, A. (2017). Sperm quality variables as indicators of bull fertility may be breed dependent. Animal Reproduction Science, 185:42-52.
Murphy, E., O’Meara, C., Eivers, B., Lonergan, P., y Fair, S. (2018). Comparison of plant-and egg yolk-based semen diluents on in vitro sperm kinematics and in vivo fertility of frozen-thawed bull semen. Animal Reproduction Science, 191, 70-75.
Quispe, G. (2018). Evaluación Comparativa de la Calidad Seminal y Funcional de Semen Criopreservado Comercial de Origen Nacional en Bovinos Lecheros de Tres Centros de Colección Seminal, Arequipa. Recuperado en línea de: https://repositorio.ucsm.edu.pe/items/b8d62998-3e74-40cd-b9bd-5a9fda23690e
Ramónez, C. (2013). Evaluación de dos agentes crioprotectores no permeables y un diluyente comercial (triladyl) en la congelación de semen bovino. Tesis de Maestría en Reproducción Animal. Universidad de Cuenca, Ecuador. Recuperado en línea de: http://dspace.ucuenca.edu.ec/bitstream/123456789/4535/1/Tesis.pdf
Ribeiro, A., Munita, L., Yumi, M., Mello, M., y Ferreira de Souza, F. (2014). Criopreservación de espermatozoides bovinos extraídos de la cola del epidídimo utilizando los métodos convencional y automatizado. Archivos de Medicina Veterinaria, 46(1), 31-38. https://dx.doi.org/10.4067/S0301-732X2014000100005
Roof, D., Bowley, S., Price, L., y Matsas, D. (2012). Comparison of two commercial extenders for cryopreservation of goat semen without sperm washing. Theriogenology, 77(2), 412-420.
Rubio-Guillén, L., Quintero-Moreno, A., y González-Villalobos, D. (2009). Efecto de la criopreservación sobre la integridad de la membrana plasmática y acrosomal de espermatozoides de toros. Revista Científica, 19(4), 382-389.
Vejarano, O., Sanabria, R., y Trujillo, G. (2005). Diagnóstico de la capacidad reproductiva de toros en ganaderías de tres municipios del alto Magdalena. Revista MVZ Córdoba, 10(2), 648-662.
Vélez C., Rugeles P., y Vergara G. (2014). Efecto de la raza sobre las características reproductivas de toros manejados en sistemas extensivos. Revista Científica, 24(4), 341-346.
Vidal, A., Batista, A, da Silva, E., Gomes, W., Pelinca, M., Silva, S., y Guerra, M. (2013). Soybean lecithin-based extender as an alternative for goat sperm cryopreservation. Small Ruminant Research, 109(1), 47-51.
Viñán D., Paucar E., y Alvarado M. (2019). Adición de metil-β-ciclodextrina cargada de colesterol sobre la criopreservación de semen de toros Holstein Friesian. Revista de Investigaciones Veterinarias del Perú, 30(4), 1611-1618. https://doi.org/10.15381/rivep.v30i4.17159