EFECTO DE DOS PROTOCOLOS DE CRIOPRESERVACIÓN DE SEMEN SOBRE LOS RESULTADOS DE INSEMINACIÓN ARTIFICIAL EQUINA
EFFECT OF TWO SEMEN CRYOPRESERVATION PROTOCOLS ON EQUINE ARTIFICIAL INSEMINATION OUTCOMES)
Carlos Fuentes. Universidad de Panamá, Facultad de Ciencias Agropecuarias. Panamá.
carlosf0784@gmail.com https://orcid.org/0009-0009-1983-501X
Félix Contreras. Universidad de Panamá, Facultad de Ciencias Agropecuarias. Panamá.
fcontreras199627@gmail.com https://orcid.org/0009-0002-9866-3533
Pacífico Bonilla. Universidad de Panamá, Facultad de Ciencias Agropecuarias. Panamá.
pacifico.bonilla@up.ac.pa https://orcid.org/0009-0006-2123-9282
*Alex Solís-Corrales. Universidad de Panamá, Facultad de Ciencias Agropecuarias. Panamá.
alex.solis@up.ac.pa https://orcid.org/0000-0002-1764-2654
*Autor de Correspondencia: alex.solis@up.ac.pa
Recibido: 12/03/2025 Aceptado: 30/04/2025
DOI https://doi.org/10.48204/j.ia.v7n2.a7493
![]()
Resumen. El objetivo de este estudio fue evaluar el efecto de dos protocolos de criopreservación de semen sobre los resultados de inseminación artificial equina. En el Tratamiento uno (T1) se realizó una centrifugación de 600 g durante 11 minutos, en cambio el Tratamiento dos (T2) se empleó una fuerza de 750 g durante ocho minutos. Se utilizaron 13 yeguas de la raza Cuarto de Milla, en edades entre cuatro a ocho años. La condición corporal de las mismas era aproximadamente entre seis y siete (en escala de uno a nueve). Se realizaron 13 inseminaciones con semen criopreservado (T1: siete inseminaciones y T2: seis inseminaciones con semen de 750 g por ocho minutos). Los datos fueron ordenados en una tabla de contingencia. Para el análisis estadístico se llevó a cabo la prueba de Chi Cuadrado, utilizando el programa IBM SPSS Statisctics versión: 29.0.0.0 (241), donde se encontraron diferencias significativas (P<0.05) para las tasas de preñez cuando se empleó el semen criopreservado en el T1 sobre el T2 (T1: 71.40% y T2: 16.70%). Se concluye que el semen criopreservado en el T1 ofreció las mejores tasas de preñez utilizando una inseminación artificial a tiempo fijo.
Palabras clave: Congelación de semen, inseminación intracornual, semen equino, sincronización del celo, tasas de preñez.
Abstract. The objective of this study was to evaluate the effect of two semen cryopreservation protocols on equine artificial insemination results. Treatment one (T1) used a centrifugation of 600 g for 11 minutes, while treatment two (T2) used a force of 750 g for eight minutes. Thirteen Quarter Horse mares, aged between four and eight years, were used. The body condition of the mares was approximately six to seven (on a scale of one to nine). Thirteen inseminations were performed with cryopreserved semen (T1: seven inseminations and T2: six inseminations with 750 g semen for eight minutes). The data were arranged in a contingency table. For the statistical analysis, the ChiSquare test was performed, using the IBM SPSS Statisctics version: 29.0.0.0 (241), where significant differences (P<0.05) were found for pregnancy rates when cryopreserved semen was used in T1 over T2 (T1: 71.40% and T2:
16.70%). It is concluded that T1 cryopreserved semen gave the best pregnancy rates using fixed-time artificial insemination.
Keywords: Equine semen, estrus synchronization, intracornual insemination, pregnancy rates, semen freezing.
INTRODUCCIÓN
La inseminación artificial (IA) con semen congelado implica la introducción oportuna de una cantidad adecuada de espermatozoides en el útero de la yegua (Samper et al., 2007). La IA es una base para otras biotecnologías que van desde la transferencia de embriones hasta la clonación. Durante décadas, la investigación sobre la IA se ha centrado en el ganado Bovino, pero durante los últimos 35 años, esta biotecnología ha ganado cada vez más popularidad en la cría de caballos.
Durante la última década, se han logrado importantes logros en el procesamiento, congelación y la inseminación con semen equino congelado. Este progreso se ha asociado con el uso de nuevas técnicas de IA, como la inseminación intracornual, nuevos diluyentes disponibles que dan como resultado una mejor criosupervivencia de los espermatozoides y técnicas de selección de esperma para aumentar la calidad del semen congelado (Alvarenga et al., 2016).
Al parecer, los dos factores de mayor relevancia hacen referencia al semen empleado en el momento de la IA, así como el sitio de inseminación (Metcalf, 2007), pues a pesar de que la fertilidad de la yegua y su manejo reproductivo son factores claves en el establecimiento de gestaciones, es importante suministrar semen de buena calidad para la IA (Vidament et al., 1997; Samper, 2008).
Al igual que en la monta natural, la longevidad de los espermatozoides dentro del tracto reproductivo de la yegua y el período de viabilidad del óvulo, determinarán el momento óptimo de la inseminación (Olguín y Esquivel, 2011).
Debido a estos factores es importante tener en cuenta la influencia de un buen proceso de criopreservación, para así preservar la capacidad fecundante del semen equino (RestrepoBetancurt et al., 2012). Es por esto que se han desarrollado diferentes agentes criopreservantes que mantienen la viabilidad de las células espermáticas después del proceso de congelación y descongelación, y que han demostrado buenas tasas de preñez.
Además, el manejo reproductivo de la yegua para IA con semen congelado puede ser costoso, y predecir el momento exacto de la ovulación es un desafío (Immonen y Cuervo-Arango, 2018), por lo cual se considera conveniente inducir la ovulación cuando la yegua presenta un folículo mayor o igual a 35 mm, y realizar la IA 24 a 48 horas después (Alonso et al., 2016).
Dicha técnica es la más recomendada cuando se insemina con semen congelado, ya que la criopreservación precapacita a los espermatozoides y reduce su capacidad de fertilización a un lapso aproximado de seis horas post IA, por lo tanto, es necesario inseminar sobre la ovulación (Alonso et al., 2016).
Las tasas de preñez en yeguas inseminadas con semen congelado varían, pero en promedio se encuentran alrededor del 50 % (Sánchez et al., 2009). Sin embargo, Loomis (2001), señaló que se pueden obtener tasas de preñez con semen congelado similares a las obtenidas con semen enfriado, pues, en un estudio realizado por este autor las yeguas inseminadas con semen enfriado (74.7% de preñez) fueron similares a las de semen congelado (75.6% de preñez).
Diversos investigadores reportan que la centrifugación, genera daños mecánicos sobre los espermatozoides equinos, los cuales dependen de la duración y fuerza con que sea ejecutada (Ramires-Neto et al., 2013). En un estudio realizado por Alvarenga et al. (2017), determinaron que la menor pérdida de células espermáticas, por daños asociados a la centrifugación, se presentó a 600 g durante 10 minutos en lugar de 1000 g durante 20 minutos.
Esto fue corroborado por Love et al. (2012), donde centrifugaron semen a 1000 g durante 20 minutos, y observaron una reducción en la movilidad y en la velocidad de los espermatozoides. Al respecto Mari et al. (2015), señalaron que una alta fuerza de centrifugación, es perjudicial para la integridad de los espermatozoides.
MATERIALES Y MÉTODOS
Para este estudio se emplearon 13 yeguas de la raza Cuarto de Milla, con edades entre cuatro y ocho años. La condición corporal de estas yeguas en promedio fue de aproximadamente entre seis y siete (en escala de 1-9) (Harvey et al., 2022).
Las yeguas fueron evaluadas reproductivamente mediante ultrasonografía transrectal, para lo cual se empleó un ecógrafo marca SIUI®, modelo CTS-800 de transductor lineal de 7.5 MHz, para descartar patologías del sistema reproductor y diagnosticar actividad cíclica normal se tomó como referencia la presencia de un cuerpo lúteo normal.
El tratamiento para realizar la inseminación a tiempo fijo consistió en sincronizar el celo de las yeguas y posteriormente a inducir la ovulación de las mismas. Para la sincronización de celo se utilizó un análogo de la hormona prostaglandina F2 alfa (PGF2α) (Ciclase Dl®) y para inducir la ovulación se utilizó gonadotropina coriónica humana (hCG), (Veterin Corion®). El protocolo utilizado se describe a continuación: El día cero se aplicaron dos centímetros cúbicos de PGF2α por vía intramuscular (IM). A partir del día tres, se inició la detección de celo exponiendo la yegua a un semental. Una vez que se manifestados los signos característicos del estro, se procedió a monitorear el tamaño del folículo preovulatorio mediante ultrasonografía. En el día cinco o seis, si el folículo presentó un tamaño igual o superior a 35 mm, se aplicaron 1500 unidades internacionales (UI) de hCG con el propósito de inducir la ovulación.
Las yeguas fueron inseminadas de 12 a 24 horas después (19.69±7.43) de la aplicación de la hCG, se utilizó semen criopreservado procedente de dos caballos Cuarto de Milla. El protocolo empleado consistió en la dilución inicialmente (1:1) con extensor. Posteriormente el semen diluido se centrifugo empleando dos fuerzas centrifugas que correspondió a dos tratamientos experimentales (T1: semen centrifugado a 600 g por 11 minutos y T2: semen centrifugado a 750 g por ocho minutos). Para su congelación, los espermatozoides se resuspendieron en diluyente Botucrio®, a una concentración de 350x106 espermatozoides/ml progresivamente motiles para ambos tratamientos. Seguido se envasó en pajuelas de 0.5 ml y se enfrió a 5 °C por 30 minutos, posteriormente se realizó la congelación del semen, las pajuelas se colocaron a 2.5 cm por encima de nitrógeno líquido durante 20 min y luego se sumergieron en él. La descongelación del semen se realizó a una temperatura de 37 ºC por 30 segundos. Seguidamente se vertió en un tubo cónico de 2 ml, y por último fue eyectado con una jeringuilla de 3 ml.
Para realizar la IA intracornual se empleó una pipeta de 65 centímetros de largo marca Minitube® indicada para IA, donde primeramente se insertó una mano en la vagina para localizar el cuello uterino con el dedo índice, luego se pasó la pipeta a través de la vagina hasta el cuello uterino, se retiró la mano de la vagina y se introdujo por el recto previamente evacuado para guiar la pipeta hacia el cuerno ipsilateral al folículo preovulatorio, una vez logrado esto, se procedió a adaptar la jeringuilla con el semen a emplear y depositar el mismo. El diagnóstico de gestación se realizó a los 16 días postinseminación.
En la Tabla 1 se presenta los valores de motilidad progresiva, vigor espermático y tasa de sobrevivencia del semen empleado para realizar el proceso de IA. De acuerdo con Sharafi et al. (2022), la motilidad progresiva corresponde a la capacidad de los espermatozoides para moverse de manera activa y rectilínea en un medio líquido. El vigor espermático se refiere a la rapidez y energía con que se mueven los espermatozoides en un medio líquido. La tasa de sobrevivencia hace referencia al porcentaje de espermatozoides que permanecen vivos luego de la descongelación del semen previamente criopreservado.
Tabla 1
Valores del semen postdescongelación para la IA.
|
Protocolo de centrifugación |
Motilidad progresiva (%) Media y desviación estándar |
Vigor espermático Escala (1-5) |
Tasa de sobrevivencia (%) Media y desviación estándar |
|
600 g por 11 minutos |
70.83 ± 10.21 |
2.83 ± 0.4 |
46.67 ± 8.16 |
|
750 g por 8 minutos |
71.67 ± 10.21 |
2.83 ± 0.4 |
56.67 ± 8.16 |
Análisis estadísticos
Para el análisis estadístico se utilizó una prueba de Chi-cuadrado (X2), se utilizó el programa IBM SSPS Statistics Versión: 29.0.0.0 (241). Para determinar si existieron diferencias significativas entre los resultados de preñez en las yeguas al utilizar semen criopreservado mediante dos protocolos.
X2= Chi-Cuadrado
Fo= Frecuencias observadas
Ft= frecuencias teóricas o esperadas.
RESULTADOS Y DISCUSIÓN
Los mayores porcentajes de preñez en este trabajo se encontraron en el T1, en el cual se utilizó un semen criopreservado con una fuerza centrífuga de 600 g por 11 minutos mientras que en el T2 que se basó en el empleo de un semen criopreservado empleando una fuerza centrífuga de 750 g por ocho minutos aportó menos porcentajes.
Figura 1
Tasas de preñez obtenidas por protocolos.
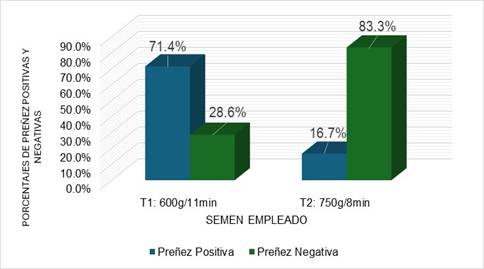
Tabla 2
Contingencia de semen empleado por porcentaje de preñez.
|
|
Porcentaje de Preñez |
Total |
|||
|
Preñadas |
No Preñadas |
||||
|
Semen Empleado |
T1: 600g/11min |
Recuento |
5 |
2 |
7 |
|
Recuento esperado |
3.2 |
3.8 |
7.0 |
||
|
% dentro de Semen Empleado |
71.4% |
28.6% |
100.0% |
||
|
T2: 750g/8min |
Recuento |
1 |
5 |
6 |
|
|
Recuento esperado |
2.8 |
3.2 |
6.0 |
||
|
% dentro de Semen Empleado |
16.7% |
83.3% |
100.0% |
||
|
Total |
Recuento |
6 |
7 |
13 |
|
|
Recuento esperado |
6.0 |
7.0 |
13.0 |
||
|
% dentro de Semen Empleado |
46.2% |
53.8% |
100.0% |
||
Al analizar la Tabla 1 mediante la prueba estadística de Chi-cuadrado nos indica que existe una diferencia significativa (P˂0.05) entre ambos tratamientos sobre los resultados de inseminación en las yeguas.
El tratamiento con semen centrifugado a 600 g por 11 minutos T1 arrojó una tasa de preñez notablemente superior (71.4%) frente al escaso 16.7% obtenido con el protocolo de 750 g por 8 minutos T2. Las tasas de preñez en yeguas con semen congelado oscilan entre el 30% a 60% según lo publicado por autores como Sánchez et al. (2009), del 25% al 40% Oliveira et al. (2013), o del 10% al 70% Alonso et al. (2016). A su vez los resultados se ven influidos por la calidad del semen, fertilidad de la yegua, manejo correcto del protocolo de IA que se realice, además del volumen y dosis de semen (Loomis, 2001; Sánchez et al., 2009).
A pesar de su relevancia, el efecto de la centrifugación del semen sobre los resultados reproductivos en yeguas ha sido escasamente abordado en la literatura científica, la cual tiende a enfocarse principalmente en variables como el método de inseminación artificial o el momento de la inducción de la ovulación.
Con el tratamiento uno se alcanzaron resultados similares (71.4%) a los reportados por Pillet et al. (2008), quienes obtuvieron porcentajes de preñez de 71%, donde se utilizó una fuerza centrífuga muy parecida a la de este trabajo en el proceso de criopreservación de semen 600 g por 10 minutos. Otros autores han reportado tasas de preñez muy variables al emplear semen centrifugado a una fuerza de 600 g por 10 min, como es el caso de Cerny et al. (2012) donde encontraron 60% de preñez, Oliveira et al. (2013), y Sielhorst et al. (2016), con 40% de preñez.
Contreras (2022), encontró que la centrifugación del semen a 750 g durante 8 minutos permitió una mejor preservación y por ende una mayor viabilidad espermática postdescongelación, en comparación con la centrifugación a 600 g por 11 minutos.
Restrepo-Betancourt et al. (2016), afirman que incluso bajos niveles de fuerza de centrifugación logran alterar la movilidad espermática, la integridad del acrosoma y el potencial de la membrana interna mitocondrial de los espermatozoides equinos. Además, menciona que estos daños se acentúan al incrementar las fuerzas y tiempos de centrifugación.
Del mismo modo, se ha demostrado que utilizar altas fuerzas centrifugas al procesar un semen de baja viabilidad o de un semental considerado subfértil, puede disminuir incluso más los porcentajes de preñez, como es el caso de Sielhorst et al. (2016), donde reportaron tasa de preñez de solo 10% utilizando un semen centrifugado a 1500 g por 15 minutos.
Ribeiro et al. (2015), demostraron que utilizar semen de un semental fértil, centrifugado a 600 g por 10 minutos en una inseminación artificial a tiempo fijo, que consistía en dos inseminaciones una vez inducida la ovulación (24 horas y 40 horas después de la inducción) se pueden obtener tasa de preñez de 80%. En este estudio con una sola inseminación realizada a las 19.69±7.43 horas después de la inducción de la ovulación, se logró una tasa de preñez muy similar a la encontrada por estos investigadores al emplear dos inseminaciones.
Entre los factores que influyen en la eficacia de la inseminación artificial, la dosis y el sitio de deposición del semen resultan determinantes, aunque su relación directa con los resultados reproductivos no siempre es sencilla de establecer. Según Cazales et al. (2020), una dosis de 250 millones de espermatozoides progresivamente móviles (PMS, siglas en ingles) es adecuada para inseminaciones en el cuerpo uterino, mientras que Fernández et al. (2008), emplearon dosis de hasta 1000 millones de PMS, logrando tasas de preñez cercanas al 80%.
En este estudio, se emplearon 800 millones de PMS por dosis, obteniéndose tasas de preñez comparables a las publicadas por Crowe et al. (2008); Avanzi et al. (2015), quienes utilizaron cantidades similares, entre 700 y 800 millones de PMS. Cabe destacar que dichos resultados favorables están estrechamente vinculados a un manejo riguroso de todo el proceso de IA.
CONCLUSIONES
La fuerza centrífuga empleada en los protocolos de criopreservación puede afectar la capacidad de fecundación de este.
Emplear una fuerza centrífuga de 600 g por 11 minutos en los protocolos de criopreservación de semen permite obtener un semen capaz de alcanzar resultados satisfactorios en cuanto a las tasas de preñez de las hembras inseminadas.
Una sola inseminación aplicada entre las 12 y 24 horas de la inducción de la ovulación brinda tasas de preñez satisfactorias con el protocolo descrito en este estudio.
Avanzi, B. R., Ramos, R. dos S., Araujo, G. H. M., Fioratti, E. G., Trinca, L. A., Dell’Aqua, J. A., Melo e Oña, C. M., Zahn, F. S., Martin, I., Alvarenga, M. A. y Papa, F. O. (2015). Fixed-time insemination with frozen semen in mares: is it suitable for poorly fertile stallions? Theriogenology, 83(9), 1389-1393. https://doi.org/10.1016/j.theriogenology.2014.07.007
Alonso, A., Baca Castex, C., Pinto, M., Caldevilla, M., Ferrante, A. y Miragaya, M. (2016). Uso de semen congelado en programas de inseminación artificial en equinos. Spermova, 2(6), 107-109. https://doi.org/10.18548/aspe/0004.04
Alvarenga, M. A., Papa, F. O. y Neto, C. R. (2017). Técnicas para incremento da qualidade do sêmen de garanhões. Revista Brasileira de Reprodução Animal, 41(1), 81-85.
Alvarenga, M. A., Papa, F. O. y Ramires Neto, C. (2016). Advances in Stallion Semen Cryopreservation. Veterinary Clinics of North America: Equine Practice, 32(3), 521-530. https://doi.org/10.1016/j.cveq.2016.08.003
Cazales Penino, N., Estradé, M. J., Costa Mattos, R., Cazales Penino, N., Estradé, M. J. y Costa Mattos, R. (2020). Inseminación artificial con semen congelado equino: reacción inflamatoria, transporte espermático y técnica de inseminación. Veterinaria (Montevideo), 56(214). https://doi.org/10.29155/vet.56.214.2
Cerny, K. L., Hughes, S., Campos, J. R., Coleman, R. J., Troedsson, M. H. T. y Squires, E. L. (2012). Fertility of Mares Inseminated With Frozen-Thawed Semen Processed by Single Layer Centrifugation Through a Colloid. Journal of Equine Veterinary Science, 32(5), 289-291. https://doi.org/10.1016/j.jevs.2011.09.075
Contreras, F. A. (2022). Evaluación de dos protocolos de criopreservación de semen equino. [Tesis de Licenciatura]. Universidad de Panamá (Panamá). Facultad de Ciencias Agropecuarias.
Crowe, C. A. M., Ravenhill, P. J., Hepburn, R. J. y Shepherd, C. H. (2008). A retrospective study of artificial insemination of 251 mares using chilled and fixed time frozen-thawed semen. Equine Veterinary Journal, 40(6), 572-576. https://doi.org/10.2746/042516408x281199
Fernández, F., Hernández, J., Rodríguez, S. y Velásquez, H. (2008). Fertilidad en yeguas cuarto de milla tratadas con gonadotropina coriónica humana (hCG) utilizando semen congelado. Revista de Salud Animal, 30(3); 184-188.
Harvey, A. M., Ramp, D. y Mellor, D. J. (2022). Review of the Foundational Knowledge Required for Assessing Horse Welfare. Animals, 12(23), 3385. https://doi.org/10.3390/ani12233385
Immonen, I. y Cuervo-Arango, J. (2020). Effect of Timing of Postovulatory Insemination Relative to Human Chorionic Gonadotropin/Buserelin Treatment With 1 Straw of Frozen-Thawed Semen on Mare Fertility. Journal of Equine Veterinary Science, 87, 102900. https://doi.org/10.1016/j.jevs.2019.102900
Loomis, P. R. (2001). The equine frozen semen industry. Animal Reproduction Science, 68(3-4), 191-200. https://doi.org/10.1016/s0378-4320(01)00156-7
Love, C. C., Blanchard, T. L., Varner, D. D., Brinsko, S. P., Voge, J., Bliss, S., Sudderth, K., Teague, S. y LaCaze, K. (2012). Effect of daily semen centrifugation and resuspension on the longevity of equine sperm quality following cooled storage. Theriogenology, 77(9), 1911-1917. https://doi.org/10.1016/j.theriogenology.2012.01.010
Mari, G., Bucci, D., Love, C. C., Mislei, B., Rizzato, G., Giaretta, E., Merlo, B. y Spinaci, M. (2015). Effect of cushioned or single layer semen centrifugation before sex sorting on frozen stallion semen quality. Theriogenology, 83(6), 953-958. https://doi.org/10.1016/j.theriogenology.2014.11.031
Metcalf, E. S. (2007). The efficient use of equine cryopreserved semen. Theriogenology, 68(3), 423–428. https://doi.org/10.1016/j.theriogenology.2007.04.039
Olguín, R. O. y Esquivel, V. R. (2011). Manual de inseminación artificial para la operatividad de semen congelado en yeguas (Equus caballus) del Criadero Militar de Ganado Santa Gertrudis Chihuahua. Universidad Autónoma Chapingo. Recuperado de https://zootecnia.chapingo.mx/assets/11olguin.pdf
Oliveira, R. A., Rubin, M. I. B. y Silva, C. A. M. (2013). Índice De Prenhez Com Sêmen Congelado De Garanhões Da Raça Crioula Usando Glicerol Ou Dimetilformamida Como Crioprotetores. Ciência Animal Brasileira, 14(4). https://doi.org/10.5216/cab.v14i4.18923
Pillet, E., Batellier, F., Duchamp, G., Furstoss, V., Vern, Y. L., Kerboeuf, D., Vidament, M. y Magistrini, M. (2008). Freezing stallion semen in INRA96®-based extender improves fertility rates in comparison with INRA82. Dairy Science and Technology. 88, 257-265 https://doi.org/10.1051/dst:2008002
Ramires-Neto, C., Monteiro, G. A., Soares, R. F., Pedrazzi, C., Dell'aqua, J. A., Papa, F. O., Castro-Chaves, M. y Alvarenga, M. A. (2013). New seminal plasma removal method for freezing stallion semen. Theriogenology, 79(7), 1120-1123.e1. https://doi.org/10.1016/j.theriogenology.2013.01.014
Restrepo-Betancurt, G., Cantero-Nanclares, J. y Montoya-Páez, J. (2016). Efecto De La Centrifugación Sobre La Integridad Y La Funcionalidad De Espermatozoides Equinos. Biotecnología en el Sector Agropecuario y Agroindustrial, 14(1), 119-125. https://doi.org/10.18684/BSAA(14)119-125
Restrepo-Betancurt, G., Duque Cortés, J. y Montoya-Páez, J. (2012). Effect of two protocols of cryopreservation on fertilizing capacity of stallion (equus caballus) semen / efecto de dos protocolos de criopreservación sobre la capacidad fecundante de semen equino (equus caballus). Universidad Nacional de Colombia - Sede Medellín. Recuperado de https://repositorio.unal.edu.co/bitstream/handle/unal/71546/36504-154209-1-PB.pdf?sequence=1&isAllowed=y
Ribeiro, B., Ramos, R., Araujo, G.H., Fioratti, E. G., Trinca, L.A., Dell´Aqua, J.A., Melo E Oña, C.M., Zahn, F.S., Martin, I., Alvarenga, M.A., y Papa, F.O. (2015). Fixed – time insemination with frozen semen in mares: is it suitable for poorly fertile stallions? Theriogenology, 83(9), 1389 – 1393. https://doi.org/10.1016/j.theriogenology.2014.07.007
Samper, J., Estrada, A. J. y McKinnon, A. O. (2007). Insemination with Frozen Semen. Current Therapy in Equine Reproduction, 285-288. https://doi.org/10.1016/b978-0-7216-0252-3.50049-7
Samper, J. C. (2008). Induction of estrus and ovulation: Why some mares respond and others do not. Theriogenology, 70(3), 445-447. https://doi.org/10.1016/j.theriogenology.2008.04.040
Sánchez, R., Gómez, I. y Samper, J. C. (2009). Artificial Insemination with Frozen Semen. Elsevier EBooks, 175-183. https://doi.org/10.1016/b978-1-4160-5234-0.00015-5
Sharafi, M., Borghei-Rad, S. M., Hezavehei, M., Shahverdi, A. y Benson, J. D. (2022). Cryopreservation of Semen in Domestic Animals: A Review of Current Challenges, Applications, and Prospective Strategies. Animals, 12(23), 3271. https://doi.org/10.3390/ani12233271
Sielhorst, J., Hagen, C., Behrendt, D., Schuette, B., Burger, D., Martinsson, G. y Sieme, H. (2016). Effect of Multiple Freezing of Stallion Semen on Sperm Quality and Fertility. Journal of Equine Veterinary Science, 40, 56-61. https://doi.org/10.1016/j.jevs.2016.01.014
Vidament, M., Dupere, A. M., Julienne, P., Evain, A., Noue, P. y Palmer, E. (1997). Equine frozen semen: Freezability and fertility field results. Theriogenology, 48(6), 907-917. https://doi.org/10.1016/s0093-691x(97)00319-1